Fortschritt und wirtschaftliche Analyse der Wasserstoffproduktion durch Elektrolyse fester Oxide
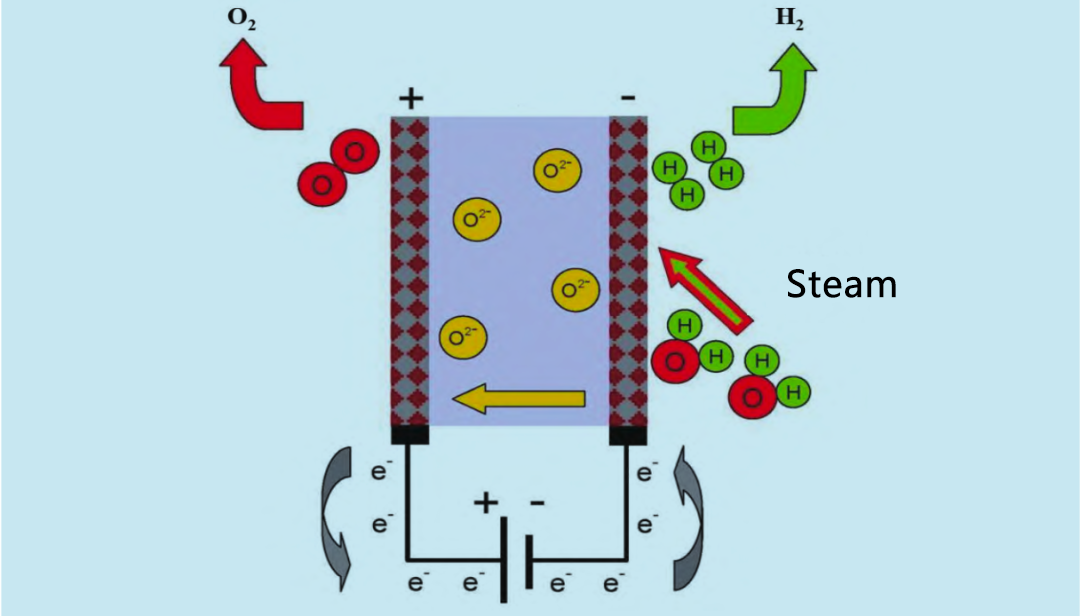
Festoxidelektrolyseure (SOE) nutzen Hochtemperatur-Wasserdampf (600–900 °C) zur Elektrolyse und arbeiten damit effizienter als alkalische und PEM-Elektrolyseure. In den 1960er Jahren begannen die USA und Deutschland mit der Forschung an Hochtemperatur-Wasserdampf-SOE. Das Funktionsprinzip des SOE-Elektrolyseurs ist in Abbildung 4 dargestellt. Recycelter Wasserstoff und Wasserdampf gelangen von der Anode in das Reaktionssystem. An der Kathode wird der Wasserdampf zu Wasserstoff elektrolysiert. Der von der Kathode erzeugte Sauerstoff gelangt durch den Festelektrolyten zur Anode, wo er zu Sauerstoff rekombiniert und Elektronen freisetzt.
Im Gegensatz zu alkalischen und Protonenaustauschmembran-Elektrolysezellen reagiert die SOE-Elektrode mit Wasserdampf. Dabei muss die Grenzfläche zwischen Elektrode und Wasserdampf maximiert werden. Daher weist die SOE-Elektrode in der Regel eine poröse Struktur auf. Ziel der Wasserdampfelektrolyse ist es, den Energiebedarf und die Betriebskosten der konventionellen Flüssigwasserelektrolyse zu senken. Obwohl der Gesamtenergiebedarf der Wasserzersetzungsreaktion mit steigender Temperatur leicht ansteigt, sinkt der elektrische Energiebedarf deutlich. Mit steigender Elektrolyttemperatur wird ein Teil der benötigten Energie als Wärme bereitgestellt. Die SOE kann in Gegenwart einer Hochtemperatur-Wärmequelle Wasserstoff produzieren. Da gasgekühlte Hochtemperatur-Kernreaktoren auf 950 °C erhitzt werden können, eignet sich Kernenergie als Energiequelle für die SOE. Gleichzeitig zeigt die Forschung, dass erneuerbare Energien wie Geothermie ebenfalls Potenzial als Wärmequelle für die Dampfelektrolyse haben. Der Betrieb bei hohen Temperaturen kann die Batteriespannung senken und die Reaktionsgeschwindigkeit erhöhen, stellt aber auch Herausforderungen hinsichtlich der thermischen Stabilität und Abdichtung des Materials dar. Darüber hinaus ist das von der Kathode erzeugte Gas ein Wasserstoffgemisch, das weiter getrennt und gereinigt werden muss, was die Kosten im Vergleich zur konventionellen Flüssigwasserelektrolyse erhöht. Der Einsatz protonenleitender Keramiken wie Strontiumzirkonat senkt die Kosten der SOE. Strontiumzirkonat weist bei etwa 700 °C eine ausgezeichnete Protonenleitfähigkeit auf und ermöglicht der Kathode die Erzeugung von hochreinem Wasserstoff, was die Dampfelektrolyse vereinfacht.
Yan et al. [6] berichteten, dass ein mit Calciumoxid stabilisiertes Zirkonoxidkeramikrohr als SOE-Trägerstruktur verwendet wurde. Die Außenfläche wurde mit einem dünnen (weniger als 0,25 mm), porösen Lanthanperowskit als Anode und einem stabilen Ni/Y2O3-Calciumoxid-Cermet als Kathode beschichtet. Bei 1000 °C, 0,4 A/cm2 und 39,3 W Eingangsleistung beträgt die Wasserstoffproduktionskapazität der Einheit 17,6 NL/h. Der Nachteil von SOE ist die Überspannung, die durch hohe Ohm-Verluste entsteht, die häufig an den Verbindungen zwischen den Zellen auftreten, und die hohe Überspannungskonzentration aufgrund der Einschränkungen des Dampfdiffusionstransports. In den letzten Jahren haben planare Elektrolysezellen viel Aufmerksamkeit auf sich gezogen [7-8]. Im Gegensatz zu röhrenförmigen Zellen ermöglichen flache Zellen eine kompaktere Herstellung und verbessern die Effizienz der Wasserstoffproduktion [6]. Das Haupthindernis für die industrielle Anwendung von SOE ist derzeit die Langzeitstabilität der Elektrolysezelle [8], und es können Probleme der Elektrodenalterung und -deaktivierung auftreten.
Beitragszeit: 06.02.2023