Progresso e análise econômica da produção de hidrogênio por eletrólise de óxidos sólidos
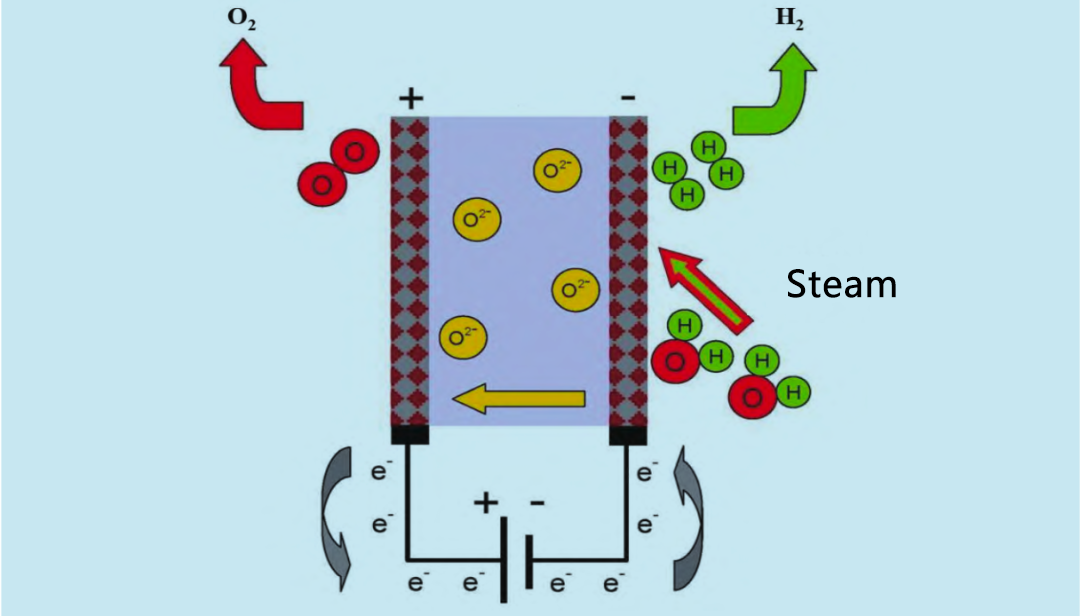
O eletrolisador de óxido sólido (SOE) utiliza vapor d'água em alta temperatura (600 ~ 900 °C) para eletrólise, sendo mais eficiente do que o eletrolisador alcalino e o eletrolisador PEM. Na década de 1960, os Estados Unidos e a Alemanha começaram a pesquisar o SOE com vapor d'água em alta temperatura. O princípio de funcionamento do eletrolisador SOE é mostrado na Figura 4. Hidrogênio e vapor d'água reciclados entram no sistema de reação a partir do ânodo. O vapor d'água é eletrolisado em hidrogênio no cátodo. O O2 produzido pelo cátodo se move através do eletrólito sólido até o ânodo, onde se recombina para formar oxigênio e liberar elétrons.
Ao contrário das células eletrolíticas alcalinas e de membrana de troca de prótons, o eletrodo SOE reage com o contato com o vapor d'água e enfrenta o desafio de maximizar a área de interface entre o eletrodo e o contato com o vapor d'água. Portanto, o eletrodo SOE geralmente possui uma estrutura porosa. O objetivo da eletrólise de vapor d'água é reduzir a intensidade energética e o custo operacional da eletrólise convencional de água líquida. De fato, embora a necessidade total de energia da reação de decomposição da água aumente ligeiramente com o aumento da temperatura, a necessidade de energia elétrica diminui significativamente. À medida que a temperatura eletrolítica aumenta, parte da energia necessária é fornecida como calor. O SOE é capaz de produzir hidrogênio na presença de uma fonte de calor de alta temperatura. Como reatores nucleares resfriados a gás de alta temperatura podem ser aquecidos a 950 °C, a energia nuclear pode ser usada como fonte de energia para o SOE. Ao mesmo tempo, a pesquisa mostra que a energia renovável, como a energia geotérmica, também tem potencial como fonte de calor para a eletrólise a vapor. Operar em alta temperatura pode reduzir a tensão da bateria e aumentar a taxa de reação, mas também enfrenta o desafio da estabilidade térmica e da vedação do material. Além disso, o gás produzido pelo cátodo é uma mistura de hidrogênio, que precisa ser separada e purificada posteriormente, aumentando o custo em comparação com a eletrólise convencional em água líquida. O uso de cerâmicas condutoras de prótons, como o zirconato de estrôncio, reduz o custo da eletrólise eletrolítica (SOE). O zirconato de estrôncio apresenta excelente condutividade de prótons a cerca de 700 °C e é propício para que o cátodo produza hidrogênio de alta pureza, simplificando o dispositivo de eletrólise a vapor.
Yan et al. [6] relataram que um tubo de cerâmica de zircônia estabilizado por óxido de cálcio foi usado como SOE da estrutura de suporte, a superfície externa foi revestida com perovskita de lantânio porosa fina (menos de 0,25 mm) como ânodo e cermet de óxido de cálcio estável Ni/Y2O3 como cátodo. A 1000 °C, 0,4 A/cm2 e 39,3 W de potência de entrada, a capacidade de produção de hidrogênio da unidade é de 17,6 NL/h. A desvantagem do SOE é a sobretensão resultante de altas perdas em ohms que são comuns nas interconexões entre as células e a alta concentração de sobretensão devido às limitações do transporte de difusão de vapor. Nos últimos anos, as células eletrolíticas planas têm atraído muita atenção [7-8]. Em contraste com as células tubulares, as células planas tornam a fabricação mais compacta e melhoram a eficiência da produção de hidrogênio [6]. Atualmente, o principal obstáculo à aplicação industrial do SOE é a estabilidade a longo prazo da célula eletrolítica [8], podendo ser causados problemas de envelhecimento e desativação do eletrodo.
Horário da publicação: 06/02/2023