Progrès et analyse économique de la production d'hydrogène par électrolyse d'oxydes solides
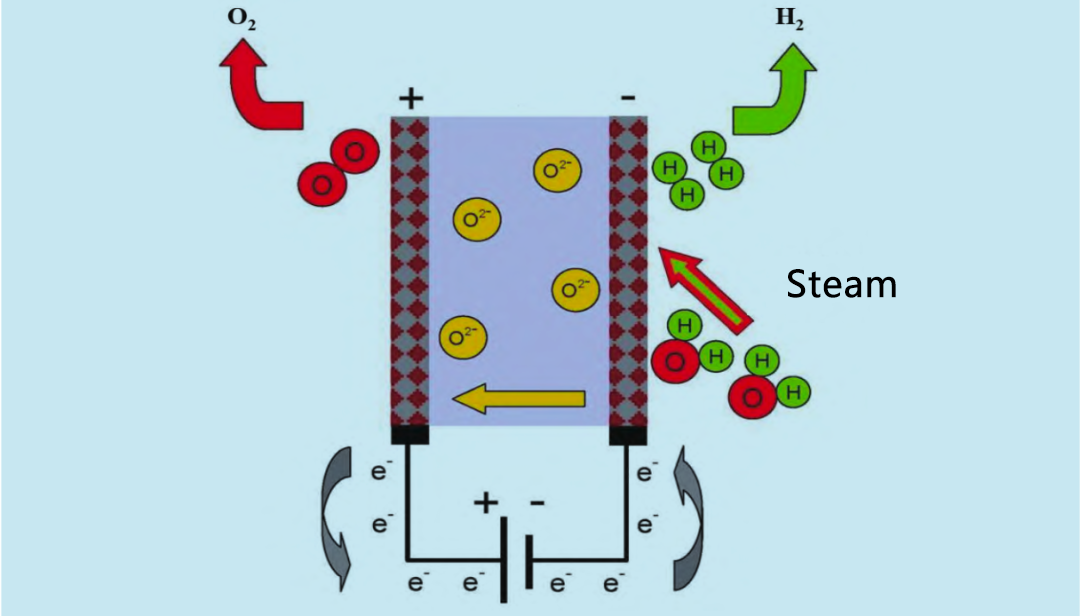
L'électrolyseur à oxyde solide (SOE) utilise de la vapeur d'eau à haute température (600 à 900 °C) pour l'électrolyse, ce qui est plus efficace que l'électrolyseur alcalin et l'électrolyseur PEM. Dans les années 1960, les États-Unis et l'Allemagne ont commencé à mener des recherches sur l'électrolyseur à oxyde solide à vapeur d'eau à haute température. Le principe de fonctionnement de l'électrolyseur SOE est illustré à la figure 4. L'hydrogène et la vapeur d'eau recyclés entrent dans le système réactionnel par l'anode. La vapeur d'eau est électrolysée en hydrogène à la cathode. L'O₂ produit par la cathode traverse l'électrolyte solide jusqu'à l'anode, où il se recombine pour former de l'oxygène et libérer des électrons.
Contrairement aux cellules électrolytiques alcalines et à membrane échangeuse de protons, l'électrode SOE réagit au contact de la vapeur d'eau et doit donc maximiser la surface d'interface entre l'électrode et le contact vapeur d'eau. Par conséquent, l'électrode SOE présente généralement une structure poreuse. L'objectif de l'électrolyse de la vapeur d'eau est de réduire l'intensité énergétique et les coûts d'exploitation de l'électrolyse de l'eau liquide classique. En effet, bien que les besoins énergétiques totaux de la réaction de décomposition de l'eau augmentent légèrement avec la température, les besoins en énergie électrique diminuent significativement. Lorsque la température électrolytique augmente, une partie de l'énergie nécessaire est fournie sous forme de chaleur. L'électrode SOE est capable de produire de l'hydrogène en présence d'une source de chaleur à haute température. Les réacteurs nucléaires refroidis au gaz à haute température pouvant atteindre 950 °C, l'énergie nucléaire peut être utilisée comme source d'énergie pour l'électrolyse de la vapeur. Parallèlement, les recherches montrent que les énergies renouvelables telles que la géothermie présentent également un potentiel comme source de chaleur pour l'électrolyse de la vapeur. Le fonctionnement à haute température peut réduire la tension de la batterie et augmenter la vitesse de réaction, mais il pose également des problèmes de stabilité thermique et d'étanchéité des matériaux. De plus, le gaz produit par la cathode est un mélange d'hydrogène, qui doit être séparé et purifié davantage, ce qui augmente le coût par rapport à l'électrolyse de l'eau liquide classique. L'utilisation de céramiques conductrices de protons, comme le zirconate de strontium, réduit le coût de l'électrolyse de l'eau liquide. Le zirconate de strontium présente une excellente conductivité protonique à environ 700 °C et permet à la cathode de produire de l'hydrogène de haute pureté, simplifiant ainsi le dispositif d'électrolyse de la vapeur.
Yan et al. [6] ont rapporté qu'un tube en céramique de zircone stabilisé par de l'oxyde de calcium a été utilisé comme SOE de la structure de support, la surface extérieure étant recouverte d'une fine pérovskite de lanthane poreuse (moins de 0,25 mm) comme anode et d'un cermet d'oxyde de calcium stable Ni/Y2O3 comme cathode. À 1 000 °C, 0,4 A/cm2 et une puissance d'entrée de 39,3 W, la capacité de production d'hydrogène de l'unité est de 17,6 NL/h. L'inconvénient du SOE est la surtension résultant des pertes ohmiques élevées qui sont courantes aux interconnexions entre les cellules, et la concentration élevée de surtension due aux limitations du transport par diffusion de vapeur. Ces dernières années, les cellules électrolytiques planes ont attiré beaucoup d'attention [7-8]. Contrairement aux cellules tubulaires, les cellules plates rendent la fabrication plus compacte et améliorent l'efficacité de la production d'hydrogène [6]. À l'heure actuelle, le principal obstacle à l'application industrielle du SOE est la stabilité à long terme de la cellule électrolytique [8], et les problèmes de vieillissement et de désactivation des électrodes peuvent être causés.
Date de publication : 6 février 2023