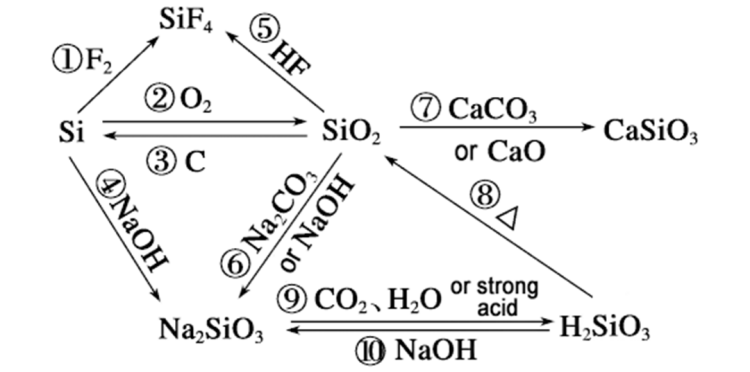
Çima rêjeya reaksiyonêsilîkonû hîdroksîda sodyûmê dikare ji ya dîoksîda silîkonê derbas bibe, dikare ji hêla aliyên jêrîn ve were analîz kirin:
Cûdahiya di enerjiya girêdana kîmyewî de
▪ Reaksiyona silîkon û hîdroksîda sodyûmê: Dema ku silîkon bi hîdroksîda sodyûmê re reaksiyonê dike, enerjiya girêdana Si-Si ya di navbera atomên silîkonê de tenê 176kJ/mol e. Girêdana Si-Si di dema reaksiyonê de dişkê, ku şikandina wê nisbeten hêsantir e. Ji aliyê kînetîk ve, reaksiyon hêsantir berdewam dike.
▪ Reaksiyona dîoksîda silîkonê û hîdroksîda sodyûmê: Enerjiya girêdana Si-O di navbera atomên silîkonê û atomên oksîjenê de di dîoksîda silîkonê de 460kJ/mol e, ku nisbeten zêde ye. Ji bo şikandina girêdana Si-O di dema reaksiyonê de enerjiyeke zêdetir lazim e, ji ber vê yekê reaksiyon nisbeten dijwar çêdibe û rêjeya reaksiyonê hêdî ye.
Mekanîzmayên reaksiyonê yên cûda
▪ Silîkon bi hîdroksîda sodyûmê re reaksiyon dike: Silîkon pêşî bi avê re reaksiyon dike da ku hîdrojen û asîda silîsîk çêbike, paşê asîda silîsîk bi hîdroksîda sodyûmê re reaksiyon dike da ku sîlîkata sodyûmê û av çêbike. Di vê reaksiyonê de, reaksiyona di navbera silîkon û avê de germê berdide, ku dikare tevgera molekulî pêşve bibe, bi vî rengî hawîrdorek kînetîk a çêtir ji bo reaksiyonê diafirîne û rêjeya reaksiyonê zûtir dike.
▪ Silîkon dîoksît bi hîdroksîda sodyûmê re reaksiyonê dike: Silîkon dîoksît pêşî bi avê re reaksiyonê dike da ku asîda silîksîk çêbike, paşê asîda silîksîk bi hîdroksîda sodyûmê re reaksiyonê dike da ku sîlîkata sodyûmê çêbike. Reaksiyona di navbera silîkon dîoksît û avê de pir hêdî ye, û pêvajoya reaksiyonê bi bingehîn germê bernade. Ji aliyê kînetîk ve, ew ne guncaw e ji bo reaksiyonek bilez.
Strukturên materyalên cûda
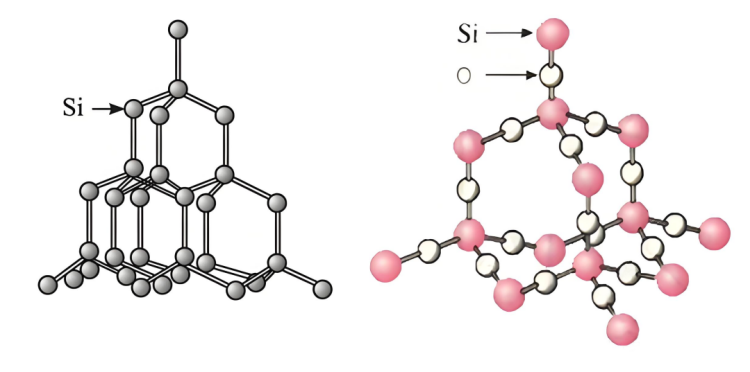
▪ Avahiya silîkonê:Sîlîkonxwedî avahiyek krîstal a diyarkirî ye, û di navbera atoman de hin valahî û têkiliyên nisbeten qels hene, ku ji bo çareseriya hîdroksîda sodyûmê têkilî û reaksiyona bi atomên silîkonê re hêsantir dike.
▪ Pêkhateyasilîkondîoksît:silîkondîoksît xwedî avahiyek tora fezayî ya stabîl e.SîlîkonAtom û atomên oksîjenê bi girêdanên kovalent bi zexmî ve girêdayî ne û avahiyek krîstal a hişk û aram çêdikin. Ji bo çareseriya hîdroksîda sodyûmê zehmet e ku bikeve hundurê wê û bi tevahî bi atomên silîkonê re têkilî dayne, di encamê de reaksiyona bilez dijwar dibe. Tenê atomên silîkonê yên li ser rûyê perçeyên dîoksîda silîkonê dikarin bi hîdroksîda sodyûmê re reaksiyonê bikin, ku rêjeya reaksiyonê sînordar dike.
Bandora şert û mercan
▪ Reaksiyona silîkonê bi hîdroksîda sodyûmê re: Di bin şert û mercên germkirinê de, rêjeya reaksiyona silîkonê bi çareseriya hîdroksîda sodyûmê re dê bi girîngî bileztir bibe, û reaksiyon bi gelemperî dikare di germahiyên bilind de bi rêkûpêk bimeşe.
▪ Reaksiyona dîoksîda silîkonê bi hîdroksîda sodyûmê re: Reaksiyona dîoksîda silîkonê bi çareseriya hîdroksîda sodyûmê re di germahiya odeyê de pir hêdî ye. Bi gelemperî, rêjeya reaksiyonê di bin şert û mercên dijwar ên wekî germahiya bilind û çareseriya hîdroksîda sodyûmê ya konsantre de çêtir dibe.
Dema şandinê: 10ê Kanûna Pêşîn a 2024an